Usa – È stato pubblicato solo qualche ora fa dal sito della Food & Drug Administration il richiamo di un lotto del vaccino anti meningite tetravalente MENVEO della GSK Vaccines. La notifica del recall è stata inviata dalla stessa casa produttrice.
Il vaccino in questione è un medicinale sottoposto a monitoraggio intensivo: per questo sul foglietto illustrativo è riportato che occorre segnalare ogni sospetto effetto indesiderato (DL n. 95 8/4/2003).
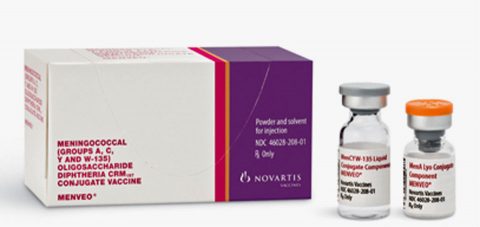
Il Numero di lotto richiamato è M16095 ed aveva scadenza Marzo 2018.
Il prodotto è costituito da 5 DOSI (10 fiale) per pacchetto – NDC 46028-208-01
NDC 46028-208-01 comprende 5 flaconi contenenti Component Conjugate Lyophilized MenA
(NDC 46028-218-11) e 5 flaconcini contenenti Component Coniugato Liquido MenCYW-135
(NDC 46028-219-11)
Il produttore è la GSK Vaccines, Srl Sovicille (SI), Italia
Menveo è indicato per l’immunizzazione attiva di bambini (di età pari o superiore ai 2 anni), adolescenti e adulti a rischio di esposizione ai gruppi A, C, W135 e Y di Neisseria meningitidis per prevenire l’insorgenza di patologie invasive.
Recall: La GlaxoSmithKline (GSK) richiama il MENVEO [Meningococcal (gruppi A, C, Y e W-135) Oligosaccharide Difteria CRM 197 Coniugato Vaccino] Soluzione per iniezione intramuscolare 5 DOSI (10 fiale) per lotto M16095. Il richiamo è una misura precauzionale poiché il lotto associato è soggetto ad un intervento meccanico eseguito durante le operazioni di riempimento asettico, non supportato dai dati di convalida.
La GSK chiede ai destinatari di (solo Menveo lot M16095 ) di smettere di distribuire e di mettere in quarantena e restituire tutte le unità.
Nel foglietto illustrativo del prodotto si legge: Controindicazioni. Ipersensibilità al principio attivo o a uno qualsiasi degli eccipienti , o al tossoide difterico (CRM197), o reazione con pericolo di vita in seguito a precedente somministrazione di un vaccino contenente componenti simili.
Per completezza il bugiardino riporta:
Si consiglia di non somministrare Menveo in concomitanza con altri vaccini, in particolare vaccini vivi, esclusi i casi di assoluta necessità. I vaccini concomitanti devono sempre essere somministrati in sedi d’iniezione distinte, preferibilmente negli arti controlaterali. Deve essere verificato se le reazioni avverse possono essere intensificate dalla somministrazione concomitante.
Se il vaccinando sta ricevendo una terapia immunosoppressiva, la risposta immunologica potrebbe essere ridotta.
Gravidanza e allattamento. Non sono disponibili dati clinici sufficienti sulle esposizioni in gravidanza. Dagli studi non clinici emerge che Menveo non produce effetti dannosi diretti o indiretti su gravidanza, sviluppo embrionale/fetale, parto o sviluppo post-natale. Considerata la gravità della malattia meningococcica invasiva causata dai sierogruppi A, C, W135 e Y di Neisseria meningitidis, la gravidanza non è un fattore di impedimento alla vaccinazione quando il rischio di esposizione è chiaramente definito.
Anche se i dati clinici sull’uso di Menveo durante l’allattamento non sono completi, è improbabile che gli anticorpi secreti nel latte costituiscano un pericolo quando assimilati da un neonato allattato. Pertanto, la casa produttrice indica che può essere utilizzato durante l’allattamento.